Expertises
Accueil > Expertises > Fonction contractile cardiaque
Fonction contractile cardiaque à PhyMedExp
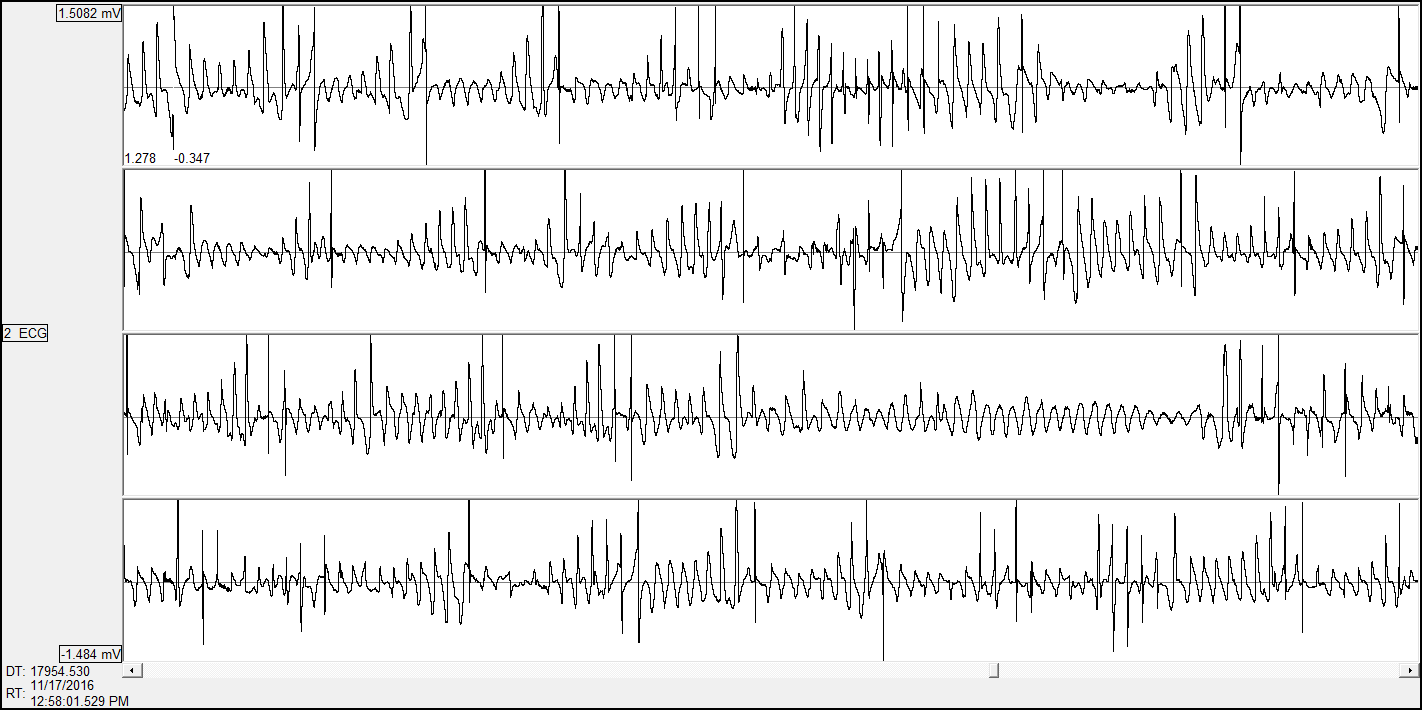
Electrocardiogramme
Le laboratoire PhyMedExp possède l’expertise et l’équipement nécessaire à l’exploration fonctionnelle cardiaque électrique chez le petit animal (rat souris) soit en télémétrie chez le rongeur vigile soit avec des électrodes de surface chez l’animal anesthésié.
Voir section electrophysiologie pour plus de détails
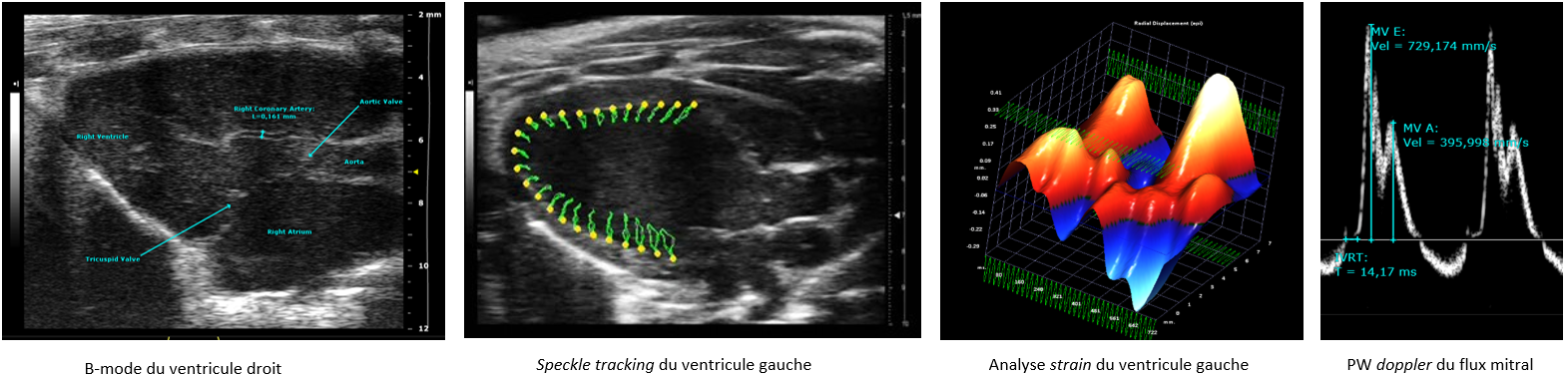
Imagerie échocardiographique haute résolution
Le plateau IPAM/PhyMedExp propose la réalisation de prestations d’imagerie ultrasonore haute résolution avec un échographe Vevo3100 (Visualsonics) équipé de 2 sondes très hautes fréquences (MX250: 21MHz, MX550D: 40MHz) spécifiquement adaptées à l’imagerie du petit animal. Une station d’imagerie, permet des réglages de positionnement en 3D (déplacements micrométriques), associée à un dispositif d’injection guidée, favorise la réalisation de protocole d’imagerie de haute précision.
Ce système d’échographie permet, de manière non-invasive et en temps réel, d’imager la function cardiaque in vivo chez le petit animal anesthésié (souris, rats) avec une excellente resolution spatiale et temporelle. Il permet de réaliser une caractérisation anatomique (ex: épaisseur des parois, diamètres et volume des cavités cardiaques) ainsi qu’une évaluation fonctionnelle et hémodynamique des tissus (ex: débits vasculaires, perfusion tissulaire, contractilité myocardique).
Ce système est dédié à l’évaluation de la fonction ventriculaire gauche et/ou droite (speckle-tracking, imagerie 4D, fonctions systolique et diastolique)
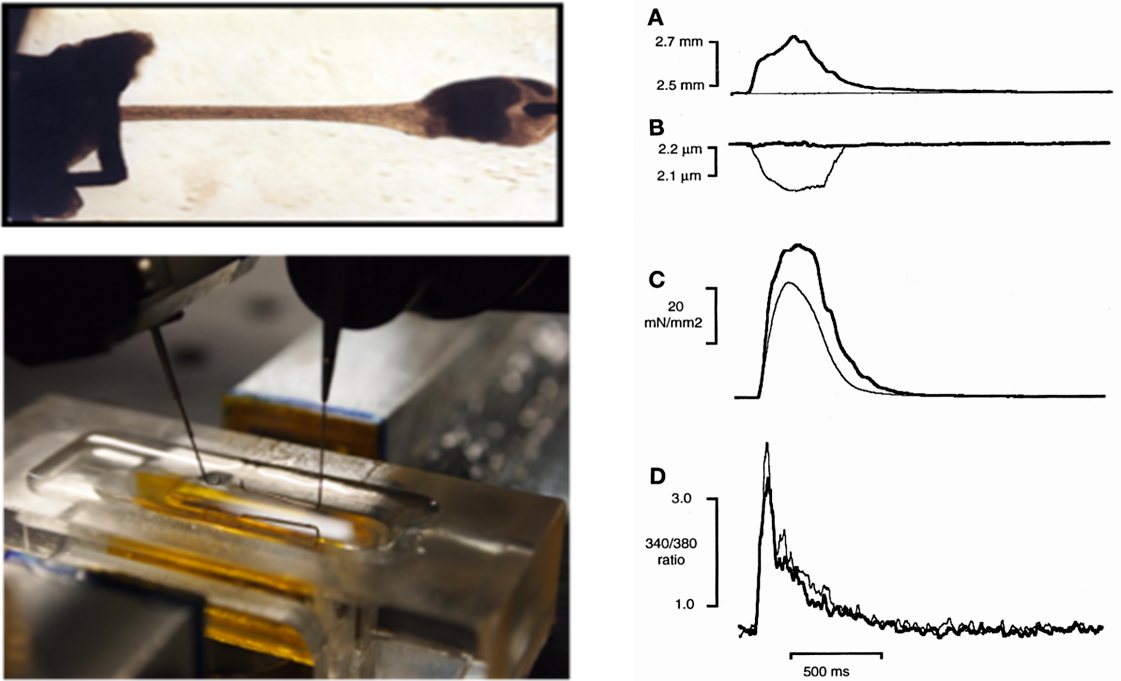
Contraction de muscles cardiaques intactes isolés
Analyse du couplage excitation-contraction de muscles cardiaques isolées (papillaires ou trabécules). Les muscles sont disséqués à partir de cœurs isolés (souris, rat, lapin, cobaye) et attachés à un moteur à grande vitesse et à un transducteur de force. Un algorithme informatique itératif dynamique permet en outre de mesurer des relations pression-volume simulées. On peut mesurer simultanément le Ca2+ intracellulaire par fluorescence (Indo-1) ou le potentiel d’action avec une électrode.
Paramètres mesurés : Force de contraction, relation de longueur force-sarcomère, cinétique de contraction, dynamique du calcium intra-cellulaire, potentiel d’action
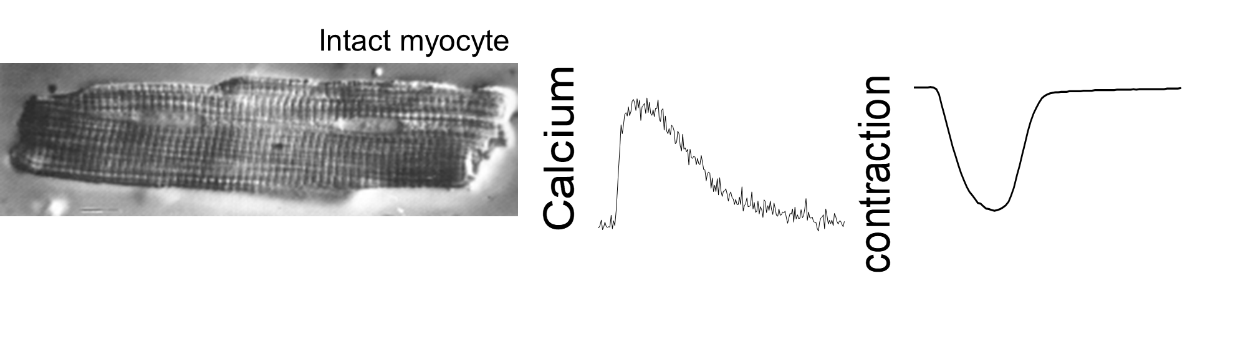
Contraction de cellules cardiaques intactes libres : contraction isotonique
Analyse du couplage excitation-contraction de cellules cardiaques (souris, rat, cobaye). Nous disposons de deux systèmes ionoptix pour mesurer simultanément la contraction des cellules cardiaques isolées (raccourcissement des sarcomères) et les mouvements de calcium par imagerie de fluorescence. L’unité dispose d’un système de fluorescence pour sonde ratiométrique mono-excitation / double émission (Indo1) et d’un système de fluorescence pour sonde ratiométrique double-excitation / mono émission (Fura, HyperSwitch light source). Autres sondes fluorescentes possibles.

Paramètres mesurés: valeurs diastoliques et systoliques, amplitude et durée de contraction/transitoire calcique, temps de contraction (vitesse de contraction) et le temps de relaxation (vitesse de relaxation).
Analyse des propriétés des myofilaments :
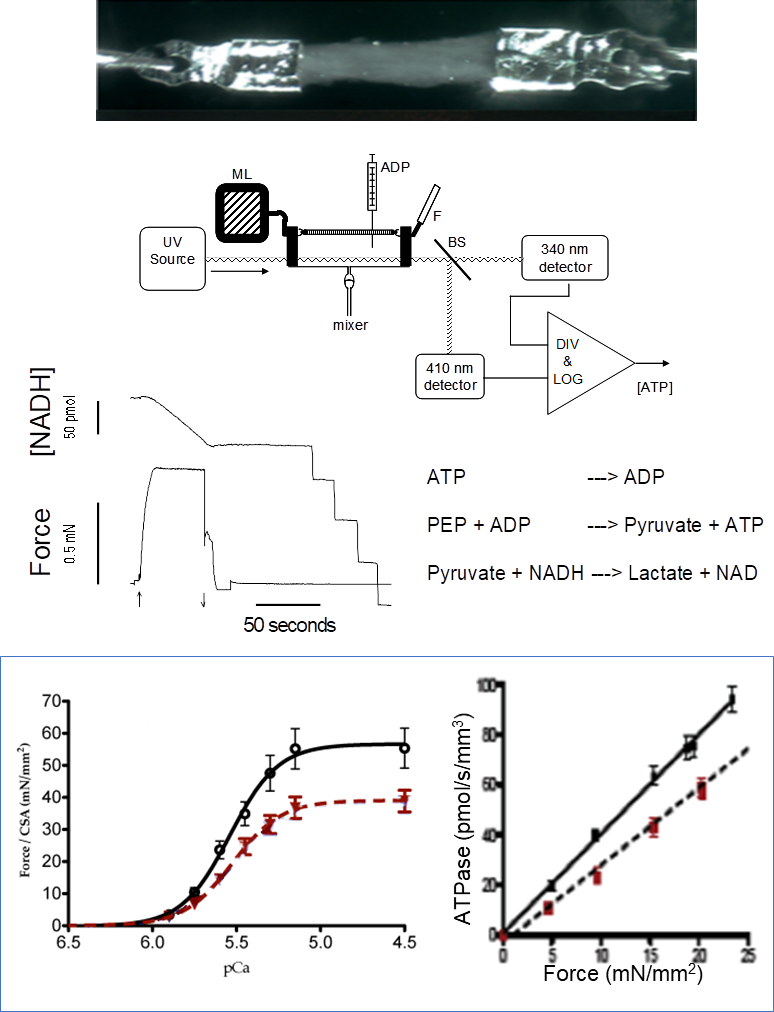
Dépendance au Ca2+ du développement de la force et taux de consommation d’ATP des ponts actine-myosine dans les muscles cardiaques et squelettiques isolés perméabilisés
Les tissus multicellulaires sont préparées à partir de muscles fraîchement isolés ou de spécimens préalablement congelés (muscle squelettique ou cardiaque; souris, rat, cobaye, humain). Les muscles sont attachés à des clips en T en aluminium (l’image montre une trabécule du ventricule gauche humain). Le muscle perméabilisé est exposé à une série de solution avec [Ca2+] variable. L’activité ATPase des ponts actine-myosine est mesurée par une réaction enzymatique couplée (comme illustré) où la vitesse d’oxydation du NADH est couplée de manière stœchiométrique à la libération d’ADP des ponts.
Paramètres mesurés: relations Force-[Ca2+], relation ATPase-Force, sensibilité au Ca2+ de la Force et activité ATPase, tension-cost, cinétiques des ponts. La figure illustre la baisse de force et le coût de la tension dans le myocarde de cobaye en insuffisance cardiaque (rouge) par rapport à un cœur contrôle (noir).
Analyse des propriétés des myofilaments : contraction de cellules cardiaques perméabilisées
Analyse spécifique des propriétés de la machinerie contractile (myofilaments) sur cellules cardiaques perméabilisées (souris, rat, cobaye, cochon, chien, Homme). Les cellules cardiaques sont isolées soit par digestion enzymatique d’un cœur « frais » soit par une technique de mixage d’un cœur congelé. Les cellules sont ensuite perméabilisées par un détergeant. La cellule est collée à des pointes métalliques dont une est reliée à un capteur de force et l’autre à un moteur pour effectuer des changements rapides de longueur.
Paramètres mesurés: rigidité cellulaire, sensibilité au calcium de la force, tension active maximale, cinétiques de formation des ponts actine-myosine.
Dynamique d’activation / relaxation des myofibrilles isolées de muscle strié

Durant une contraction, l’appareil contractile cardiaques ou squelettique est temporairement activé par une montée rapide puis une chute rapide de Ca2+ intracellulaire. L’évolution temporelle de la contraction est déterminée par les propriétés temporelles du signal d’activation de Ca2+ et la réponse dynamique temporelle de la machinerie protéique contractile. La technique de la myofibrille unique permet l’évaluation biophysique de cette propriété vitale. Les myofibrilles isolées sont obtenues par homogénéisation du muscle squelettique congelé (exemple du haut: psoas de lapin) ou cardiaque (exemple du bas: ventricule gauche humain). Dimensions typiques : 30 à 100 µm de longueur et 3-7 µm de diamètre. La myofibrille est attachée à des micro-outils en verre qui servent de contrôleur de longueur rapide et de capteur de force. Les myofibrilles sont perfusées via un système capable de modifier la composition de la solution de perfusion en ~ 3 millisecondes. Une manœuvre rapide de libération-étirement pendant l’activation complète permet l’évaluation de la cinétique de cyclage des ponts (Ktr).
Paramètres mesurés: taux d’activation (Kact), taux de récupération de force (Ktr), biphasique linéaire (Krel.Lin et Trel.Lin) et taux de relaxation exponentielle subséquent (Krel.Exp), développement de la force maximale, sensibilité au Ca2+. De plus, la réponse dynamique du myofilament à tout changement rapide de substrat (par exemple phosphate) peut être mesurée.